找到回家的路—如何治療失智症?
失智症的現狀
失智症是一個進行性退化的疾病,從輕微症狀,逐漸進入中度、重度、末期症狀,因有個別差異,疾病退化的時間不一定。主要可分為退化性及血管性兩大類,退化性以阿茲海默症最多,約占50~60%;其次為血管性失智症(腦中風引起,約20%),及其他疾病引起的失智症,如巴金森氏症的患者有40%的患者合併失智症。但患者有時會存在兩種或以上的病因,最常見的則是阿茲海默症與血管性失智症並存(又稱為混合型)。
國際失智症協會在2019年報告全球失智症人口超過5000萬人,而這個數字到了2050年人數將高達1億3150萬人。而花費在失智症的照護成本在2018年已經超過1兆美元。而台灣根據衛生福利部的110年12月底人口資料與台灣失智症流行病學調查的結果,台灣目前失智症總人口數推估為31.2萬人,佔全國總人口1.34 %,亦即在台灣約每74人中即有1人是失智者。而在65歲以上的老人每13人即有1位失智者,而80歲以上的老人則每5人即有1位失智者。
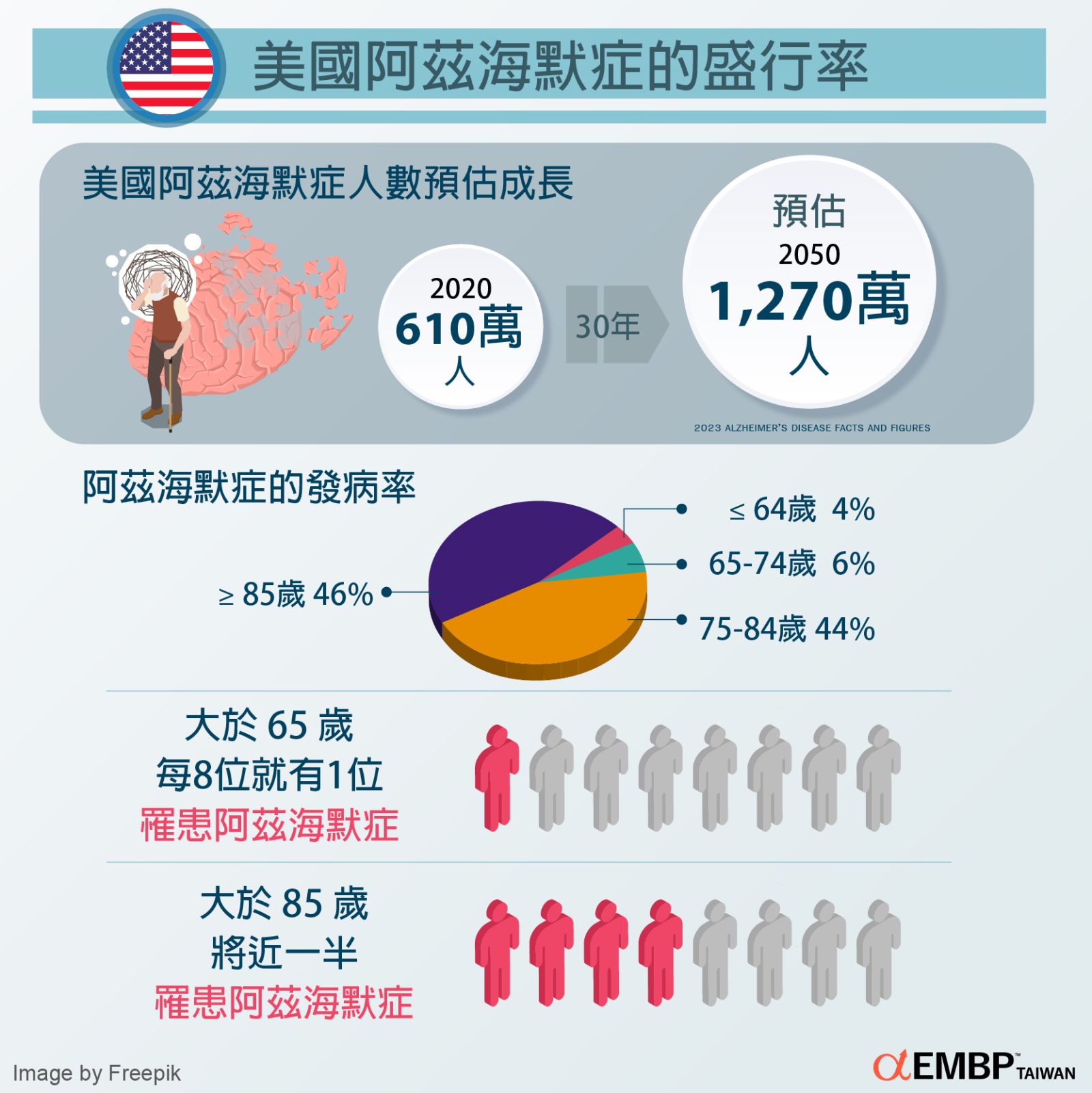
在失智症之中,阿茲海默症占失智症的人口比例最高,美國在2020年統計約有610萬的患者,是一種會明顯損壞並影響大腦多重部位的一種神經退化性癡呆症,嚴重限制記憶、推理與認知功能。阿茲海默症的發生率會隨著年齡的增加而明顯增加。2019年美國因阿茲海默症而死亡已經登上十大死因的第六名,罹患率也節節高升:
- 年齡 ≥ 65 歲的人中,每8位就有1位罹患阿茲海默症。
- 年齡 ≥85 歲的人,有將近一半罹患阿茲海默症。
- 在罹患阿茲海默症的人口中,預估有4%年齡小於65歲,6%年齡介於65至74歲間,44%年齡介於75至84歲間而46%年齡 ≥85歲。
阿兹海默症病因
阿茲海默症的特徵是許多大腦皮質和一些皮質下區域的神經元和突觸喪失功能,導致受影響區域大量萎縮。在顯微鏡下,阿茲海默症病患大腦中的類澱粉蛋白質斑和神經纖維糾結都清楚可見。蛋白質斑是高密度不溶於水的β類澱粉蛋白質和細胞內容物在神經細胞周圍堆積形成,神經纖維糾結則是由微管相關蛋白質Tau蛋白質過度磷酸化並且堆積在細胞內聚集而成,雖然許多老年人都會因為老化而在大腦出現蛋白質斑和神經纖維糾結,相較之下,阿茲海默症病患在大腦中的特殊區域如顳葉有更多這些病變。
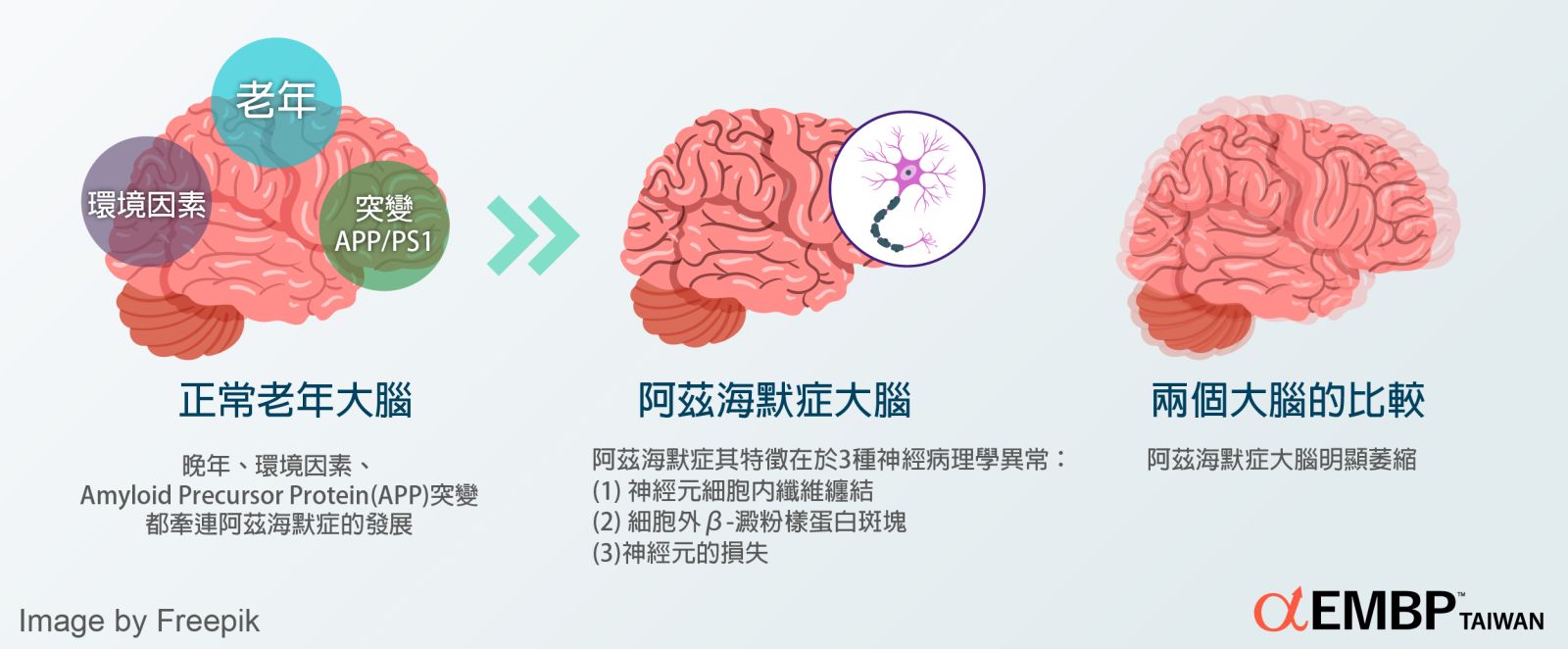
細胞內神經纖維糾結,細胞外 β-澱粉樣蛋白斑塊,神經元喪失,這是阿茲海默症主要的神經病理異常。此類異常可以回溯至幾個源頭,包括喪失製造神經傳導物質乙醯膽鹼的神經元、支撐相關神經元傳導能力的蛋白質與分子異常(谷氨酸路徑受損)與相關基因轉錄功能退化等。這些源頭導致蛋白斑塊的產生、讓負責建構神經的神經纖維產生糾結, 並透過傳送不正確、異常的訊號導致細胞死亡。大腦連串出現的受損可以透過 EEG、MEG 以及其他造影技術觀察到的神經活動、大腦代謝、神經元密度與基因表現明顯看出。
阿兹海默症症狀
阿茲海默症(AD)是最常見的癡呆症,患者會出現神經退化速度加劇的情況,進而影響記憶力、注意力、專注力與正常的認知過程。這樣的情況會因為年紀增長造成葡萄糖代謝功能不佳與中斷、血壓降低以及神經元死亡等因素而變嚴重。為了補償血液供給量與葡萄糖的減少,大腦會減緩突觸與整體的溝通速度,進而導致攸關資訊接收、整合與更高階認知功能的大腦部位腦波活動減緩。此外,這樣的轉變也會降低大腦的連貫性,因為大腦各功能部位之間的傳導中斷。一旦處於這樣的狀態,即使處理該疾患的核心機轉,大腦還是無法完全復原,因為症狀本身已經到了積重難返的地步。只有透過全面的計畫,才可能完全處理所有症狀與疾病的成因。
阿茲海默症患者可能會出現下列徵象:
- 難以學會並回想新的資訊
- 失去定向感
- 不穩定的情緒與行為變化增加
- 對於常見人事物的困惑加深
- 喪失記憶
- 無法入睡、吞嚥,有時也會無法走路
- 東西亂放
- 判斷能力差
- 無法閱讀或寫字
- 妄想、激動
- 難以從事簡單的日常活動,如:穿衣、刷牙與沐浴等
治療阿兹海默症
雖然目前尚無已知可根治阿茲海默症的方法,但是可以透過運動或其他治療方式協助預防或減緩阿茲海默症惡化的速度。只是此類方式至今無法證明是否能有效逆轉病情或完全遏止阿茲海默症,使其不再惡化。目前的治療方式與藥物的使用在於:
- 減緩疾病惡化的速度
- 設計一個更適合病情惡化的患者居住的環境
- 治療症狀
藥物
下列幾個已經取得FDA 許可,能夠用於治療阿茲海默症的藥物。
一、乙醯膽鹼酶抑制劑(Acetyl-cholinesterase inhibitor)
- 機轉:減少乙醯膽鹼的分解,使乙醯膽鹼增加,以補足阿茲海默症病患所缺乏的神經傳導物質。
- 目前市面上FDA和台灣衛生福利部核准的主要使用藥物有: Donepezil(愛憶欣)、Rivastigmine(憶斯能)、Galantamine(佳能憶)。
二、NMDA受體拮抗劑(NMDA natagonist)
- 機轉:阿茲海默症的症狀與中樞神經系統的 NMDA(N-methyl-D-aspartate)接受體連續受到glutamate 的刺激有關,而Memantine(威智) 是屬於非競爭性NMDA接受體的阻斷劑,對中重度阿茲海默症患者較為有效。
上述藥物的作用主要是改善認知功能、行為混亂和日常生活執行能力。近年美國FDA也批准了新型的失智症藥物上市,新的機轉致力於直接清除腦中的類澱粉蛋白沉積進而改善認知功能的惡化,目前上市的藥物有2021年的Aducanumab以及2023年的Lecanemab,臨床實驗顯示可減緩認知退化的速度。雖然新藥發明讓失智症治療浮現新的契機,然而目前台灣尚未引進這種新藥,而實際臨床改善效果以及可能副作用仍有待時間驗證。
介入性療法與照護
因為目前並無可靠的阿茲海默症單一治療方式可供選擇,延緩認知退化進程的介入治療主要為認知訓練,運用輔助教具、日常生活設計認知活動,或是增加外在刺激與新事物學習,增進失智症個案動腦的機會。最佳的方式往往在於確保受該疾患所苦的個人及家庭能夠獲得慰藉,必須小心照料,彌補阿茲海默症導致的任何或所有的認知功能與其他功能喪失。
EMBP保護神經的做法
經顱磁刺激術(rTMS)在目前針對阿茲海默症已經有相當多的研究證明對其症狀有所幫助,特別是在早期至中度的患者上。EMBP是一種新型個體化的經顱磁刺激療法,這種療法結合病人的臨床症狀,病史,EEG腦電掃描和其他生物學節律,利用隨機共振的原理,選擇最佳治療參數。通過EEG,醫務人員可以間接瞭解病人的腦能量代謝狀態以及神經信息傳達和處理的有效性。這個創新的治療方式可直接處理阿茲海默症常見的神經缺陷與後果,將大腦活動導回更穩健、改善的神經狀態。
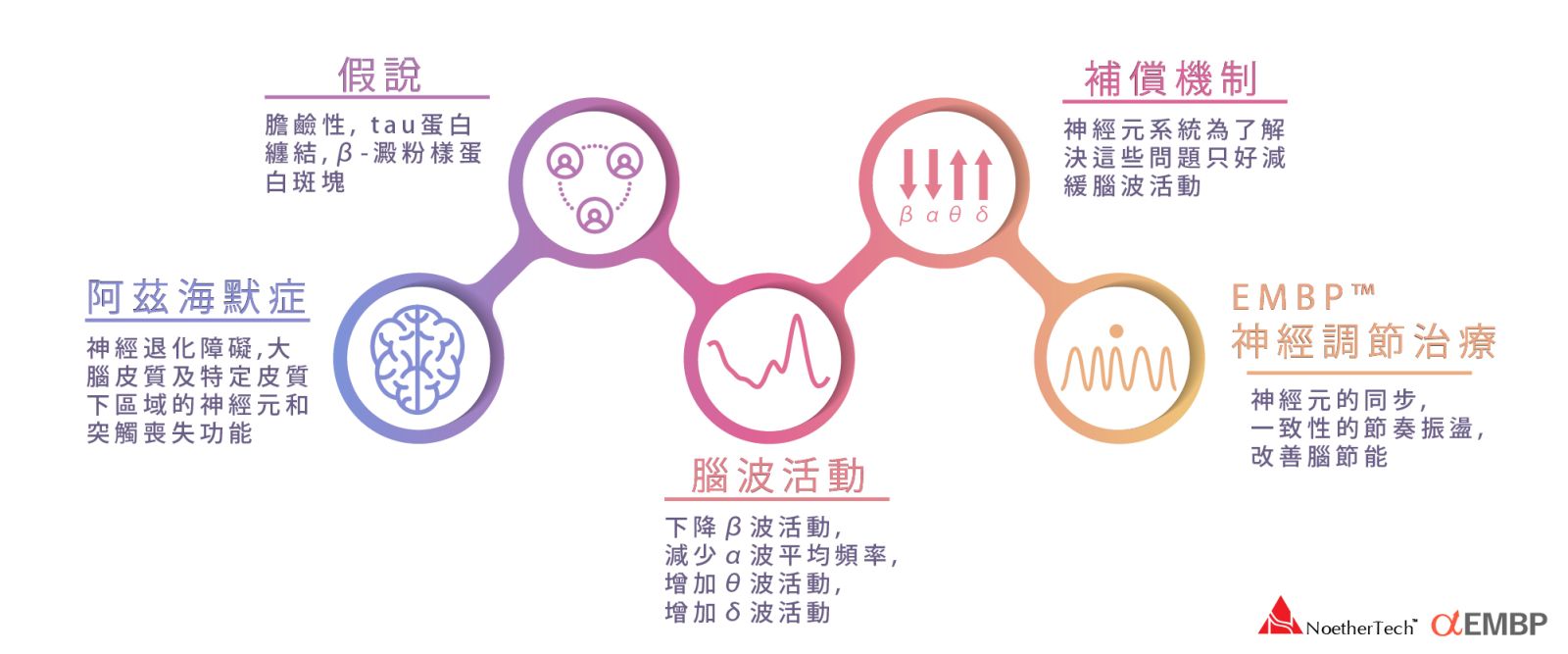
上面提到的介入性治療目的是延緩或預防阿茲海默症發作,包括讓心智處於活躍狀態、學習新的活動以及改變每天的例行公事等。這些方式也許有助於確保穩健的神經功能,但是卻無法帶來治癒該疾患或保護神經、讓該疾患獲得緩衝、不再惡化的結果。EMBP療法不僅能夠保護神經而且可能有助於改善大腦整體的聯貫性,讓大腦內的葡萄糖代謝變得正常。大部份病患都明顯恢復記憶力,推理與認知功能也得到改善。例如有位九十多歲長者,阿茲海默症病史已有十多年,平時只能幾個單語,記憶力也幾乎完全衰退。經過幾個療程就很快恢復部份記憶,很多年沒有寫過字開始重新寫字,也能回應音樂的節奏,語言表達也變得多而靈巧。
阿茲海默症的治療其實要多面向的整合,包含藥物、日常照護、家庭支持。我們瞭解阿茲海默症患者家屬對於照護病患所付出的心力是難以比喻的,我們極盡可能使EMBP治療達到成果,讓病患改善大腦功能,恢復部分記憶力,得到推理與認知功能的進步。每位病患因年齡和腦部神經老化或損壞程度不同而改善恢復的效果也就不盡相同。長足的進步固然可喜,有些患者雖然只得到部份的改善,但對日常生活的幚助是很大的。所以我們很建議在疾病的初期就能積極地提升大腦功能,讓整體退化速度不至於太快。能夠在人生的晚期與家人平安相處,含飴弄孫,擁有健全的社交活動,對於失智症的病患生活品質的提高是我們最關心的一件事。
EMBP治療失智症實例分享
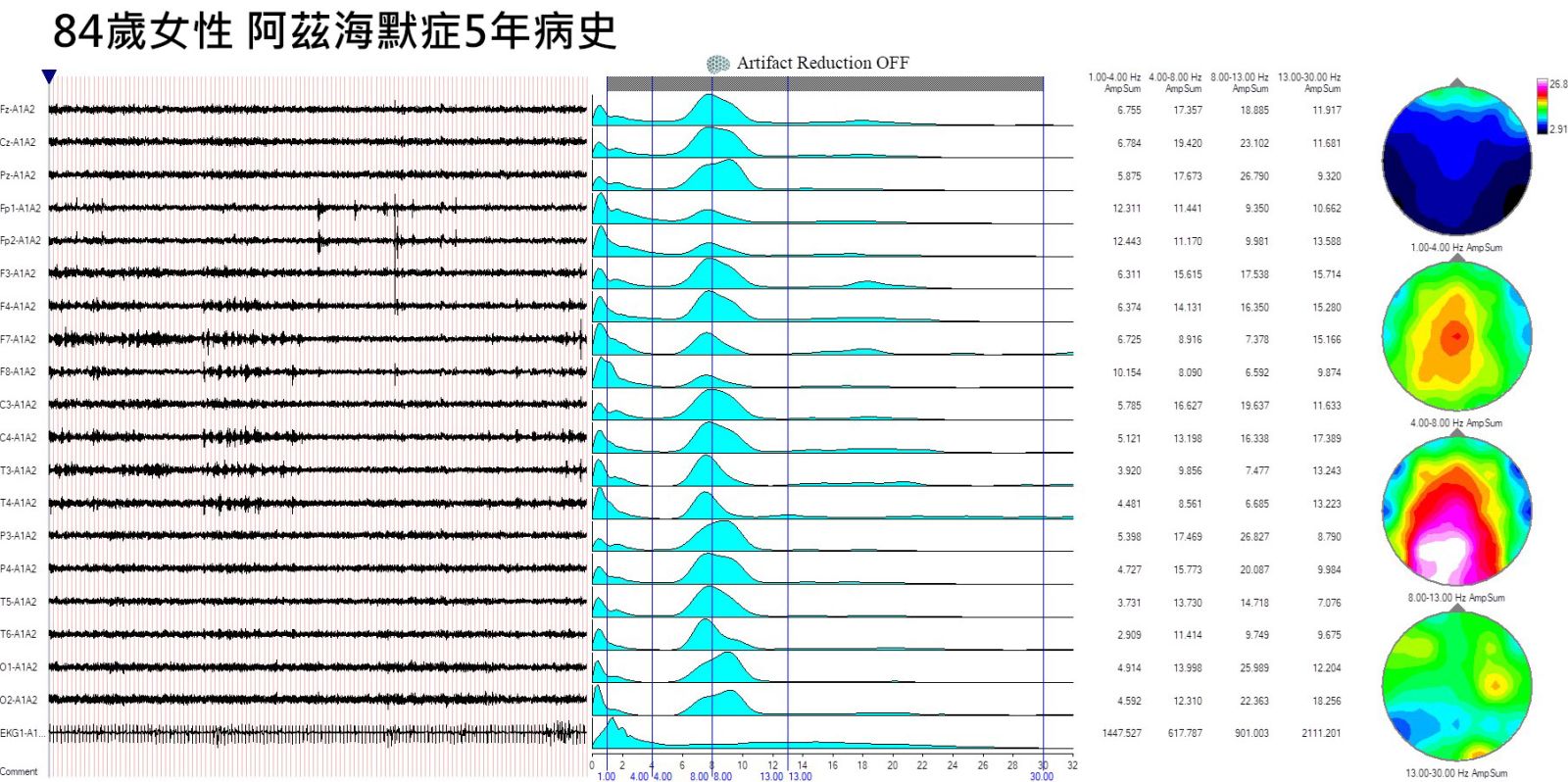
84歲女性,經診斷阿茲海默症已經5年,定期服用藥物控制,但患者平時記憶力不佳,經常碎念有人拿了她的錢,睡眠凌亂,經常半夜起來對外籍看護態度不佳。初始的腦波檢查我們可以發現大腦固有頻率有部分區域已經變慢,整體頻率落至8Hz以下,所以功能不如年輕時候的狀態。
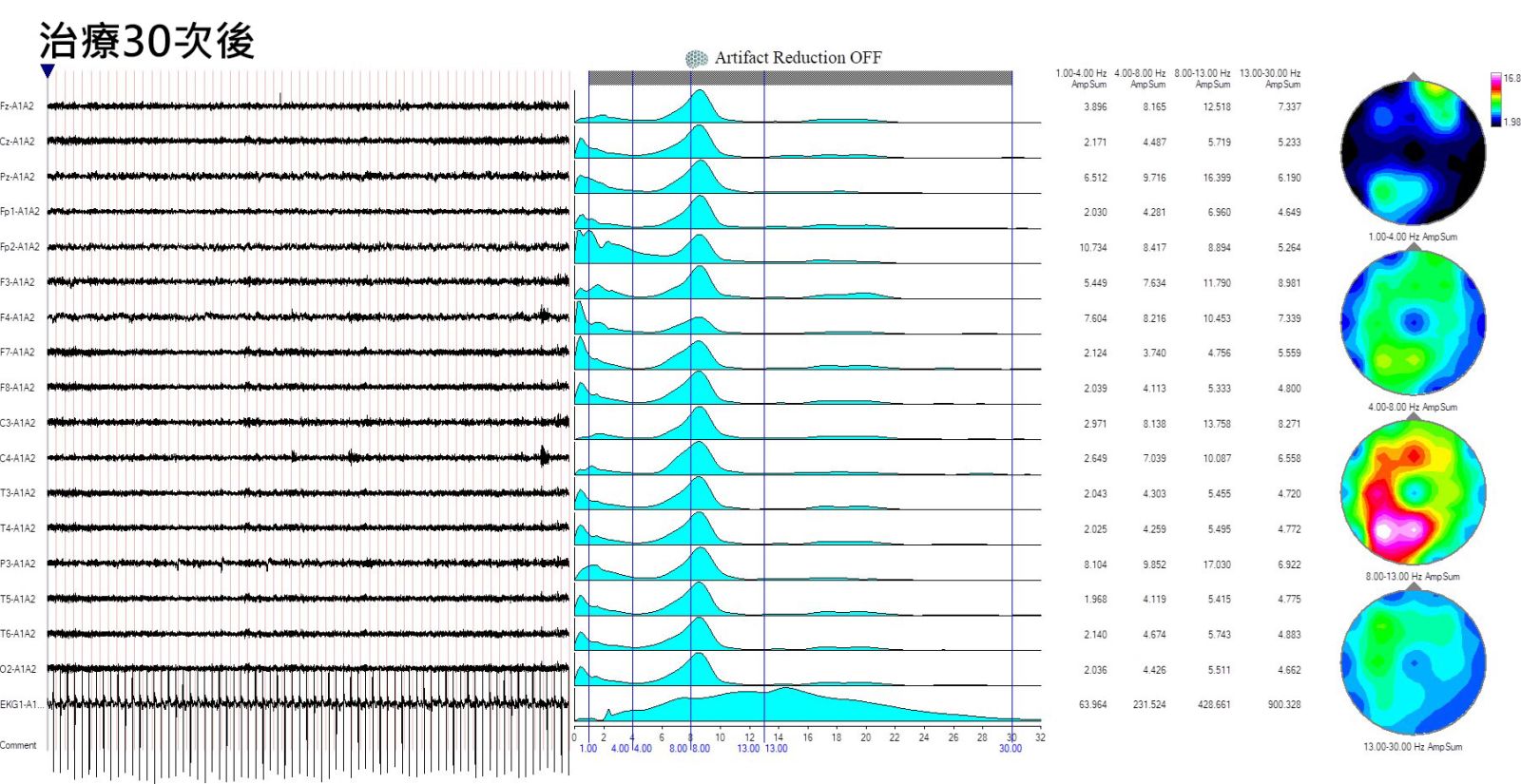
經過30次的療程之後,我們發現病人的大腦頻率逐漸規整,且大部分都可以維持在8Hz以上,臨床上病患整體精神變好,夜晚的睡眠品質改善很多,比較願意跟人溝通,不再為雞毛蒜皮小事計較,短期記憶雖然還是不好,但對於人和地點的辨識能力和印象明顯改善,整體生活機能和品質提升。
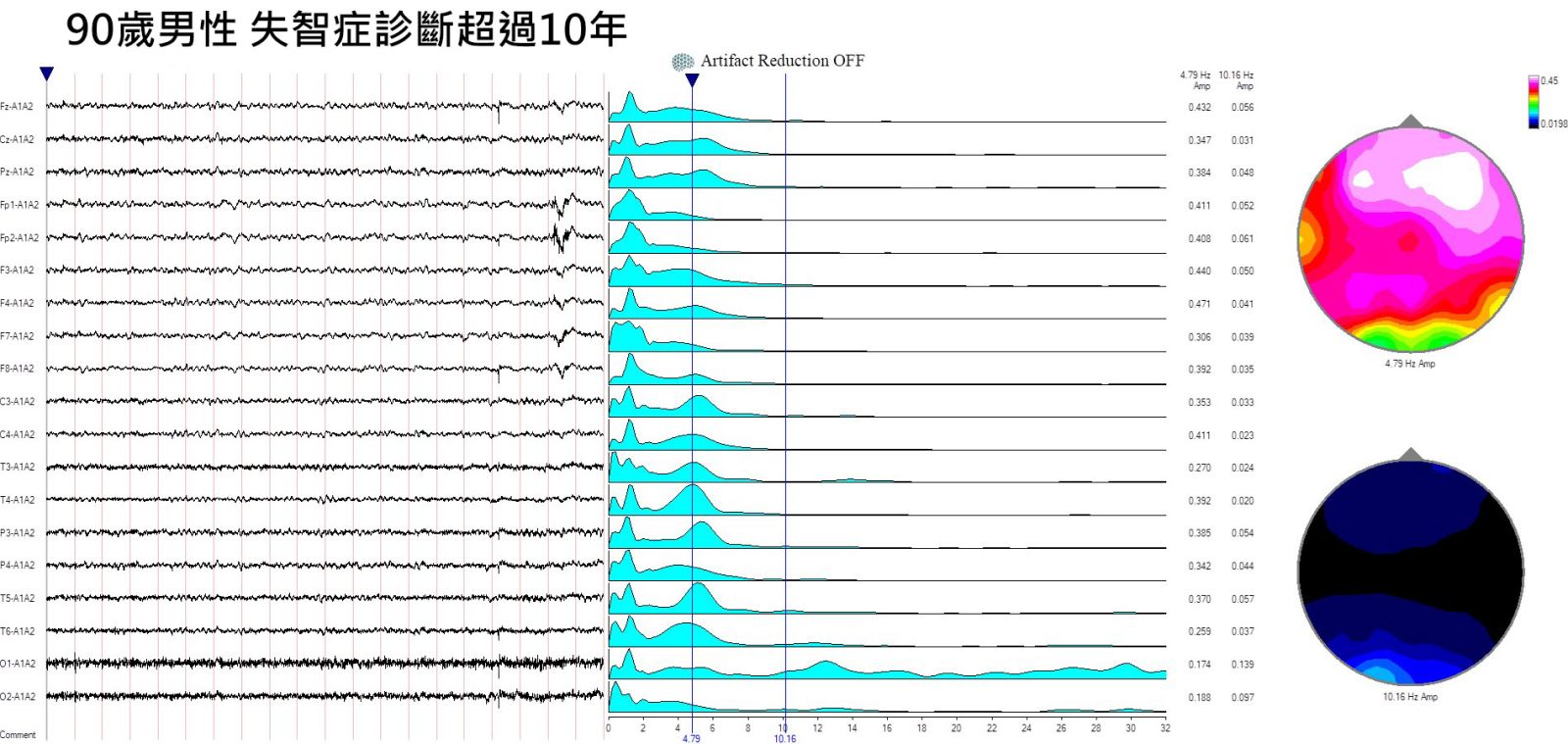
第二個例子是上面文章提到的90歲男性,失智症診斷超過10年,無法行走,只能依靠輪椅,沒有言語溝通。我們幫他做定量腦電圖檢查可以發現除了頻率緩慢以外,腦波也無法集中,幾乎沒有正常的Alpha頻率腦波。
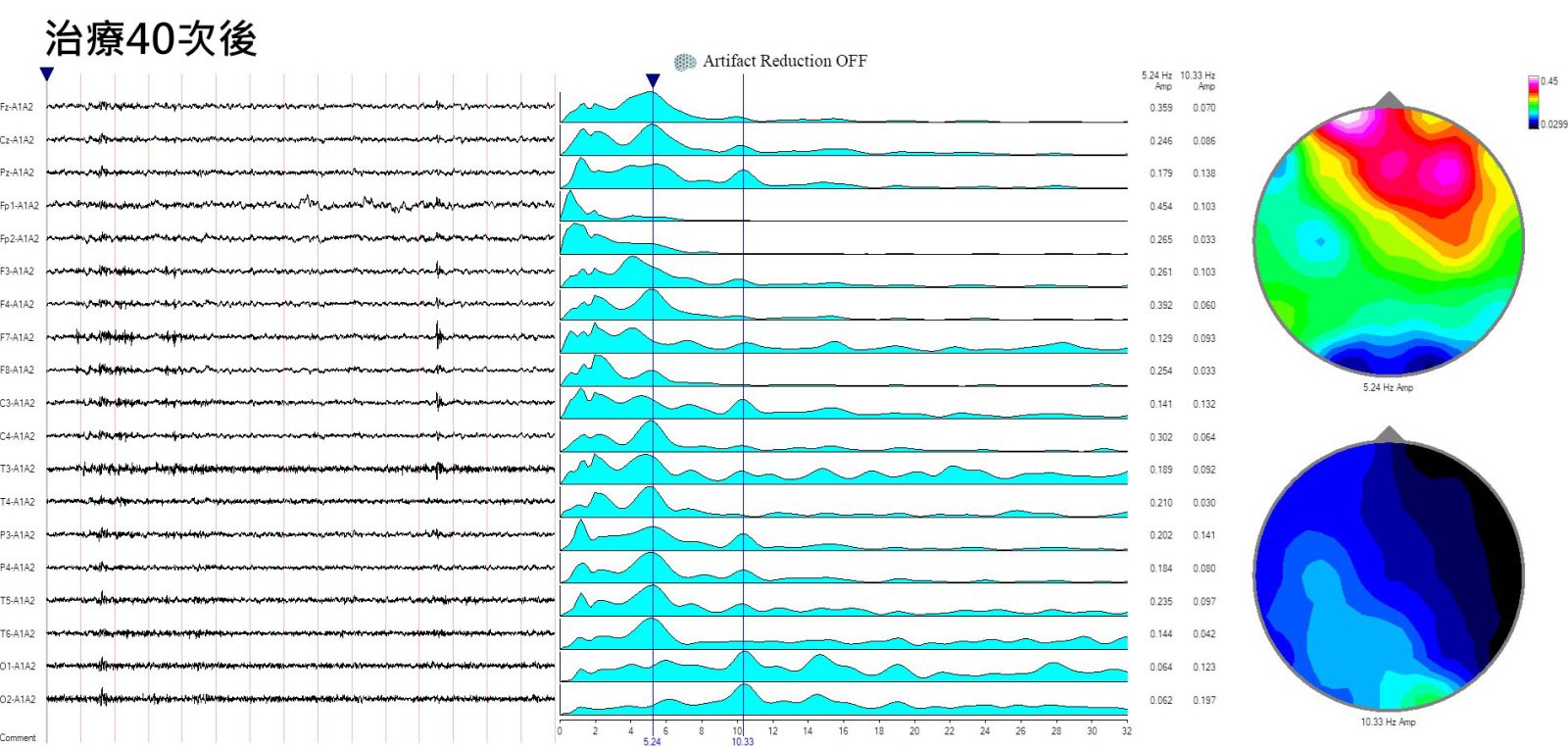
經過我們大約40次的治療之後,他可以拄著拐杖走路進來診所治療,很久沒寫書法的技能也突然恢復了。我們發現整體腦波的規律性提高,屬於正常頻率的Alpha波也逐漸出現。
參考文獻
- Knopman, David S., et al. Failure to demonstrate efficacy of aducanumab: An analysis of the EMERGE and ENGAGE trials as reported by Biogen. Alzheimer’s Dement. 2020;1-6.
- Marina Weiler, Kevin C. Stieger, Jeffrey M. Long, Peter R. Rapp. Transcranial Magnetic Stimulation in Alzheimer’s Disease: Are We Ready?. ENEURO 2020 Jan-Feb; 7(1)
- Zhenyu Wei, Jiaqi Fu, Huazheng Liang, Mingli Liu, Xiaofei Ye, Ping Zhong. The therapeutic efficacy of transcranial magnetic stimulation in managing Alzheimer’s disease: A systemic review and meta-analysis. Frontiers Aging Neuroscience, 06 September 2022
- Giacomo Koch, Elias Paolo Casula, et al. Precuneus magnetic stimulation for Alzheimer’s disease: a randomized, sham-controlled trial. Brain, Volume 145, Issue 11, November 2022, Pages 3776–3786
- https://www.alz.org/media/Documents/alzheimers-facts-and-figures.pdf
失智症的現狀
失智症是一個進行性退化的疾病,從輕微症狀,逐漸進入中度、重度、末期症狀,因有個別差異,疾病退化的時間不一定。主要可分為退化性及血管性兩大類,退化性以阿茲海默症最多,約占50~60%;其次為血管性失智症(腦中風引起,約20%),及其他疾病引起的失智症,如巴金森氏症的患者有40%的患者合併失智症。但患者有時會存在兩種或以上的病因,最常見的則是阿茲海默症與血管性失智症並存(又稱為混合型)。
國際失智症協會在2019年報告全球失智症人口超過5000萬人,而這個數字到了2050年人數將高達1億3150萬人。而花費在失智症的照護成本在2018年已經超過1兆美元。而台灣根據衛生福利部的110年12月底人口資料與台灣失智症流行病學調查的結果,台灣目前失智症總人口數推估為31.2萬人,佔全國總人口1.34 %,亦即在台灣約每74人中即有1人是失智者。而在65歲以上的老人每13人即有1位失智者,而80歲以上的老人則每5人即有1位失智者。
在失智症之中,阿茲海默症占失智症的人口比例最高,美國在2020年統計約有610萬的患者,是一種會明顯損壞並影響大腦多重部位的一種神經退化性癡呆症,嚴重限制記憶、推理與認知功能。阿茲海默症的發生率會隨著年齡的增加而明顯增加。2019年美國因阿茲海默症而死亡已經登上十大死因的第六名,罹患率也節節高升:
- 年齡 ≥ 65 歲的人中,每8位就有1位罹患阿茲海默症。
- 年齡 ≥85 歲的人,有將近一半罹患阿茲海默症。
- 在罹患阿茲海默症的人口中,預估有4%年齡小於65歲,6%年齡介於65至74歲間,44%年齡介於75至84歲間而46%年齡 ≥85歲。

阿兹海默症病因
阿茲海默症的特徵是許多大腦皮質和一些皮質下區域的神經元和突觸喪失功能,導致受影響區域大量萎縮。在顯微鏡下,阿茲海默症病患大腦中的類澱粉蛋白質斑和神經纖維糾結都清楚可見。蛋白質斑是高密度不溶於水的β類澱粉蛋白質和細胞內容物在神經細胞周圍堆積形成,神經纖維糾結則是由微管相關蛋白質Tau蛋白質過度磷酸化並且堆積在細胞內聚集而成,雖然許多老年人都會因為老化而在大腦出現蛋白質斑和神經纖維糾結,相較之下,阿茲海默症病患在大腦中的特殊區域如顳葉有更多這些病變。
細胞內神經纖維糾結,細胞外 β-澱粉樣蛋白斑塊,神經元喪失,這是阿茲海默症主要的神經病理異常。此類異常可以回溯至幾個源頭,包括喪失製造神經傳導物質乙醯膽鹼的神經元、支撐相關神經元傳導能力的蛋白質與分子異常(谷氨酸路徑受損)與相關基因轉錄功能退化等。這些源頭導致蛋白斑塊的產生、讓負責建構神經的神經纖維產生糾結, 並透過傳送不正確、異常的訊號導致細胞死亡。大腦連串出現的受損可以透過 EEG、MEG 以及其他造影技術觀察到的神經活動、大腦代謝、神經元密度與基因表現明顯看出。
阿兹海默症症狀
阿茲海默症(AD)是最常見的癡呆症,患者會出現神經退化速度加劇的情況,進而影響記憶力、注意力、專注力與正常的認知過程。這樣的情況會因為年紀增長造成葡萄糖代謝功能不佳與中斷、血壓降低以及神經元死亡等因素而變嚴重。為了補償血液供給量與葡萄糖的減少,大腦會減緩突觸與整體的溝通速度,進而導致攸關資訊接收、整合與更高階認知功能的大腦部位腦波活動減緩。此外,這樣的轉變也會降低大腦的連貫性,因為大腦各功能部位之間的傳導中斷。一旦處於這樣的狀態,即使處理該疾患的核心機轉,大腦還是無法完全復原,因為症狀本身已經到了積重難返的地步。只有透過全面的計畫,才可能完全處理所有症狀與疾病的成因。
阿茲海默症患者可能會出現下列徵象:
- 難以學會並回想新的資訊
- 失去定向感
- 不穩定的情緒與行為變化增加
- 對於常見人事物的困惑加深
- 喪失記憶
- 無法入睡、吞嚥,有時也會無法走路
- 東西亂放
- 判斷能力差
- 無法閱讀或寫字
- 妄想、激動
- 難以從事簡單的日常活動,如:穿衣、刷牙與沐浴等
治療阿兹海默症
雖然目前尚無已知可根治阿茲海默症的方法,但是可以透過運動或其他治療方式協助預防或減緩阿茲海默症惡化的速度。只是此類方式至今無法證明是否能有效逆轉病情或完全遏止阿茲海默症,使其不再惡化。目前的治療方式與藥物的使用在於:
- 減緩疾病惡化的速度
- 設計一個更適合病情惡化的患者居住的環境
- 治療症狀
藥物
下列幾個已經取得FDA 許可,能夠用於治療阿茲海默症的藥物。
一、乙醯膽鹼酶抑制劑(Acetyl-cholinesterase inhibitor)
- 機轉:減少乙醯膽鹼的分解,使乙醯膽鹼增加,以補足阿茲海默症病患所缺乏的神經傳導物質。
- 目前市面上FDA和台灣衛生福利部核准的主要使用藥物有: Donepezil(愛憶欣)、Rivastigmine(憶斯能)、Galantamine(佳能憶)。
二、NMDA受體拮抗劑(NMDA natagonist)
- 機轉:阿茲海默症的症狀與中樞神經系統的 NMDA(N-methyl-D-aspartate)接受體連續受到glutamate 的刺激有關,而Memantine(威智) 是屬於非競爭性NMDA接受體的阻斷劑,對中重度阿茲海默症患者較為有效。
上述藥物的作用主要是改善認知功能、行為混亂和日常生活執行能力。近年美國FDA也批准了新型的失智症藥物上市,新的機轉致力於直接清除腦中的類澱粉蛋白沉積進而改善認知功能的惡化,目前上市的藥物有2021年的Aducanumab以及2023年的Lecanemab,臨床實驗顯示可減緩認知退化的速度。雖然新藥發明讓失智症治療浮現新的契機,然而目前台灣尚未引進這種新藥,而實際臨床改善效果以及可能副作用仍有待時間驗證。
介入性療法與照護
因為目前並無可靠的阿茲海默症單一治療方式可供選擇,延緩認知退化進程的介入治療主要為認知訓練,運用輔助教具、日常生活設計認知活動,或是增加外在刺激與新事物學習,增進失智症個案動腦的機會。最佳的方式往往在於確保受該疾患所苦的個人及家庭能夠獲得慰藉,必須小心照料,彌補阿茲海默症導致的任何或所有的認知功能與其他功能喪失。
EMBP保護神經的做法
經顱磁刺激術(rTMS)在目前針對阿茲海默症已經有相當多的研究證明對其症狀有所幫助,特別是在早期至中度的患者上。EMBP是一種新型個體化的經顱磁刺激療法,這種療法結合病人的臨床症狀,病史,EEG腦電掃描和其他生物學節律,利用隨機共振的原理,選擇最佳治療參數。通過EEG,醫務人員可以間接瞭解病人的腦能量代謝狀態以及神經信息傳達和處理的有效性。這個創新的治療方式可直接處理阿茲海默症常見的神經缺陷與後果,將大腦活動導回更穩健、改善的神經狀態。
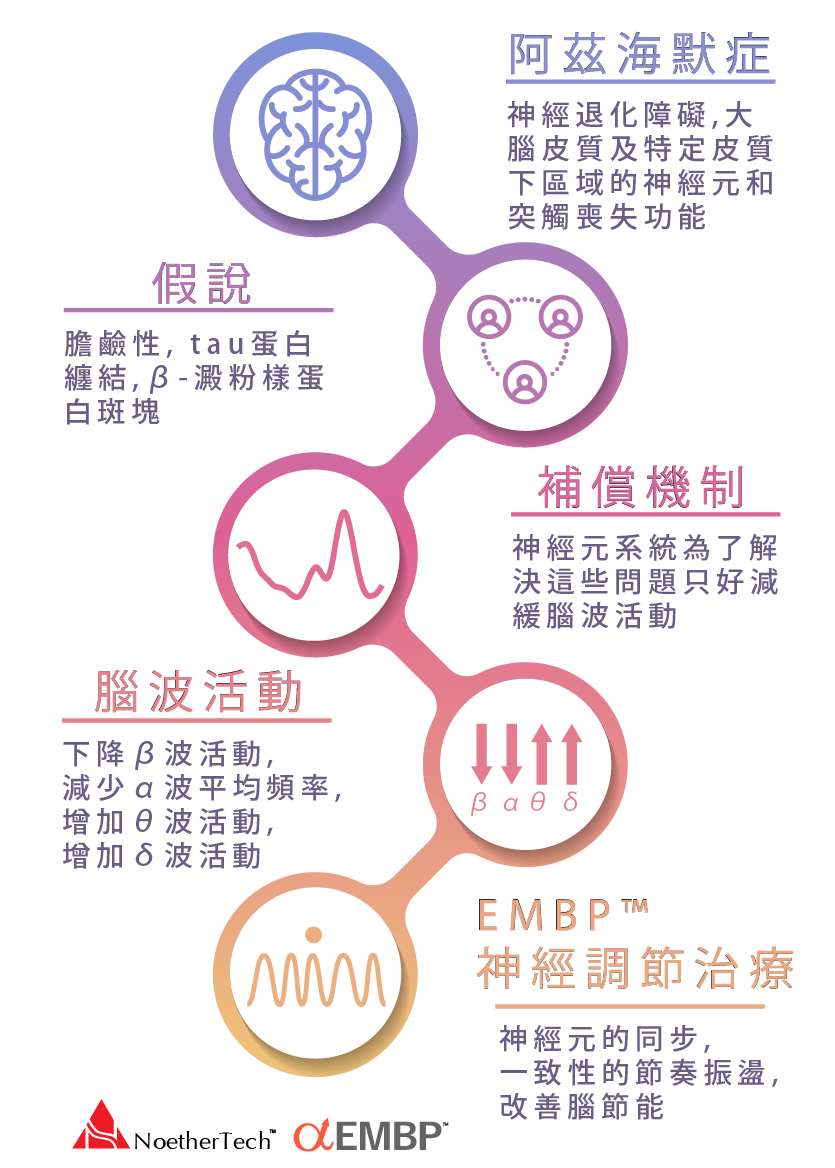
上面提到的介入性治療目的是延緩或預防阿茲海默症發作,包括讓心智處於活躍狀態、學習新的活動以及改變每天的例行公事等。這些方式也許有助於確保穩健的神經功能,但是卻無法帶來治癒該疾患或保護神經、讓該疾患獲得緩衝、不再惡化的結果。EMBP療法不僅能夠保護神經而且可能有助於改善大腦整體的聯貫性,讓大腦內的葡萄糖代謝變得正常。大部份病患都明顯恢復記憶力,推理與認知功能也得到改善。例如有位九十多歲長者,阿茲海默症病史已有十多年,平時只能幾個單語,記憶力也幾乎完全衰退。經過幾個療程就很快恢復部份記憶,很多年沒有寫過字開始重新寫字,也能回應音樂的節奏,語言表達也變得多而靈巧。
阿茲海默症的治療其實要多面向的整合,包含藥物、日常照護、家庭支持。我們瞭解阿茲海默症患者家屬對於照護病患所付出的心力是難以比喻的,我們極盡可能使EMBP治療達到成果,讓病患改善大腦功能,恢復部分記憶力,得到推理與認知功能的進步。每位病患因年齡和腦部神經老化或損壞程度不同而改善恢復的效果也就不盡相同。長足的進步固然可喜,有些患者雖然只得到部份的改善,但對日常生活的幚助是很大的。所以我們很建議在疾病的初期就能積極地提升大腦功能,讓整體退化速度不至於太快。能夠在人生的晚期與家人平安相處,含飴弄孫,擁有健全的社交活動,對於失智症的病患生活品質的提高是我們最關心的一件事。
EMBP治療失智症實例分享

84歲女性,經診斷阿茲海默症已經5年,定期服用藥物控制,但患者平時記憶力不佳,經常碎念有人拿了她的錢,睡眠凌亂,經常半夜起來對外籍看護態度不佳。初始的腦波檢查我們可以發現大腦固有頻率有部分區域已經變慢,整體頻率落至8Hz以下,所以功能不如年輕時候的狀態。

經過30次的療程之後,我們發現病人的大腦頻率逐漸規整,且大部分都可以維持在8Hz以上,臨床上病患整體精神變好,夜晚的睡眠品質改善很多,比較願意跟人溝通,不再為雞毛蒜皮小事計較,短期記憶雖然還是不好,但對於人和地點的辨識能力和印象明顯改善,整體生活機能和品質提升。

第二個例子是上面文章提到的90歲男性,失智症診斷超過10年,無法行走,只能依靠輪椅,沒有言語溝通。我們幫他做定量腦電圖檢查可以發現除了頻率緩慢以外,腦波也無法集中,幾乎沒有正常的Alpha頻率腦波。

經過我們大約40次的治療之後,他可以拄著拐杖走路進來診所治療,很久沒寫書法的技能也突然恢復了。我們發現整體腦波的規律性提高,屬於正常頻率的Alpha波也逐漸出現。
參考文獻
- Knopman, David S., et al. Failure to demonstrate efficacy of aducanumab: An analysis of the EMERGE and ENGAGE trials as reported by Biogen. Alzheimer’s Dement. 2020;1-6.
- Marina Weiler, Kevin C. Stieger, Jeffrey M. Long, Peter R. Rapp. Transcranial Magnetic Stimulation in Alzheimer’s Disease: Are We Ready?. ENEURO 2020 Jan-Feb; 7(1)
- Zhenyu Wei, Jiaqi Fu, Huazheng Liang, Mingli Liu, Xiaofei Ye, Ping Zhong. The therapeutic efficacy of transcranial magnetic stimulation in managing Alzheimer’s disease: A systemic review and meta-analysis. Frontiers Aging Neuroscience, 06 September 2022
- Giacomo Koch, Elias Paolo Casula, et al. Precuneus magnetic stimulation for Alzheimer’s disease: a randomized, sham-controlled trial. Brain, Volume 145, Issue 11, November 2022, Pages 3776–3786
- https://www.alz.org/media/Documents/alzheimers-facts-and-figures.pdf
